フラボノイドプロシアニジンC1は感覚療法活性があり、マウスの寿命を延ばします
概要
加齢に伴う臓器の機能低下と加齢に伴う慢性病変のリスクの増加は、老化に関連する分泌表現型(SASP)を発症する老化細胞の蓄積によって部分的に促進されます。ここでは、ブドウ種子抽出物(GSE)のポリフェノール成分であるプロシアニジンC1(PCC1)が、老化細胞への作用を通じてマウスの健康寿命と寿命を延ばすことを示します。天然物のライブラリーをスクリーニングすることにより、GSEとその有効成分の1つであるPCC1が老化細胞に特定の影響を与えることがわかりました。低濃度では、PCC1はSASP形成を阻害するように見えますが、おそらく活性酸素種の産生とミトコンドリア機能障害を促進することにより、高濃度で老化細胞を選択的に殺します。げっ歯類モデルでは、PCC1は、治療によって損傷を受けた腫瘍微小環境で老化細胞を枯渇させ、化学療法と併用すると治療効果を高めます。PCC1を照射、老化細胞移植、または自然老化した老齢マウスに断続的に投与すると、身体機能障害が軽減され、生存期間が延長されます。PCC1は、in vivo活性を持ち、加齢に伴う病状を遅らせ、緩和し、予防するための臨床的介入としてさらに発展する可能性が高い天然の老化療法剤として特定されています。
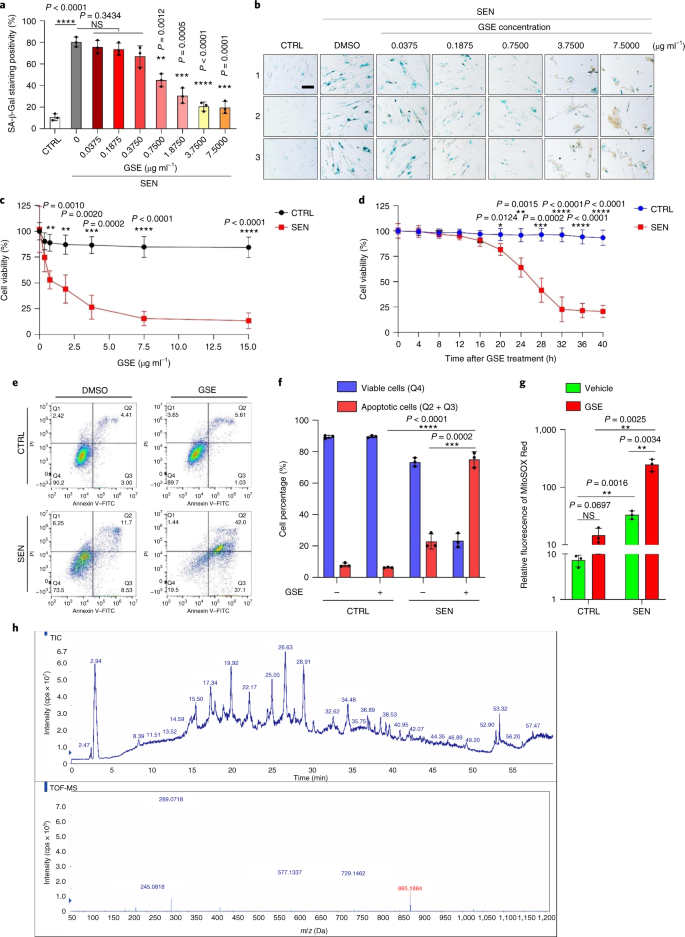
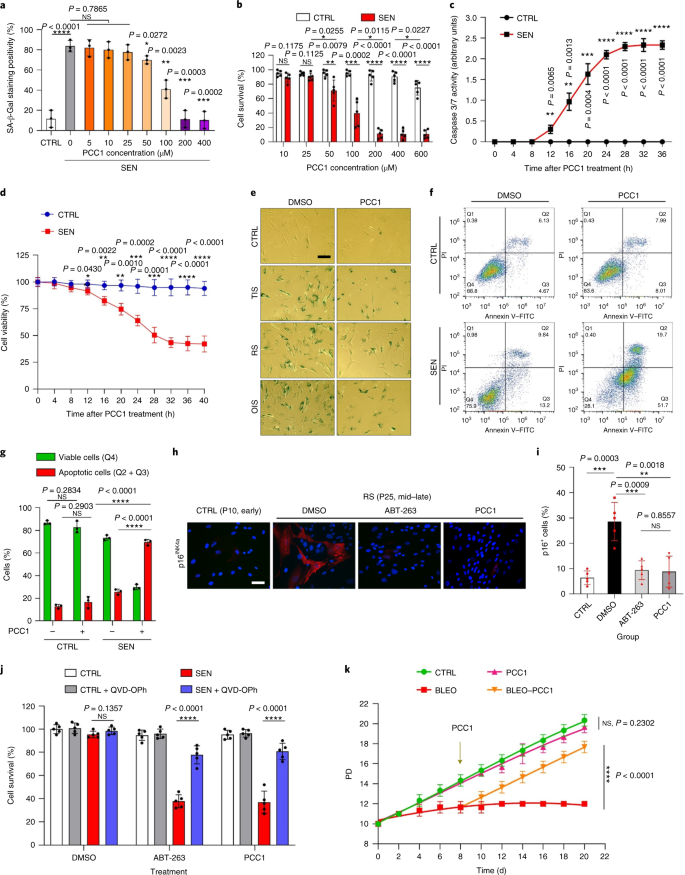
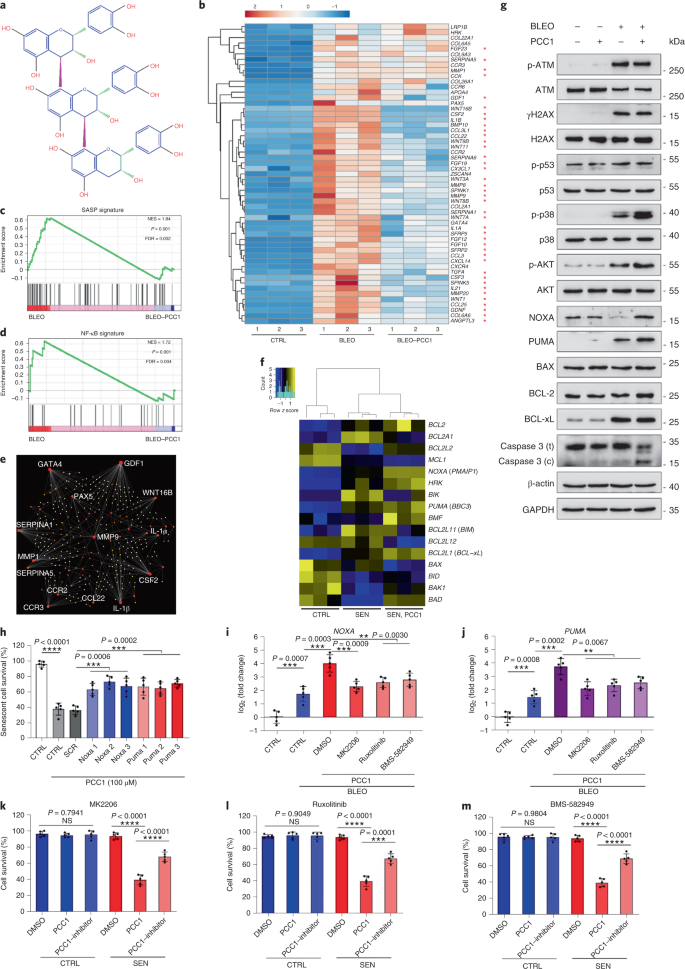
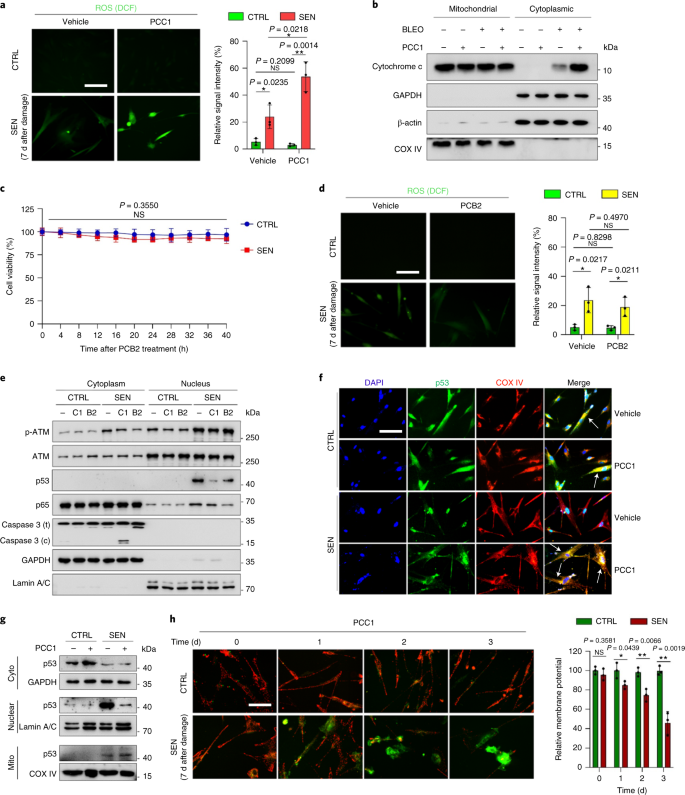
老化は、心血管疾患、代謝性疾患、神経変性病態、多様な悪性疾患などの慢性疾患の最大の危険因子の1つであり、これらが合わさって、世界の罹患率、死亡率、および医療費の大部分を占めています。1。2型糖尿病、骨粗鬆症、骨格の脆弱性、血管機能障害など、個々の加齢に伴う状態を治療するための特定の薬剤を開発するために、近年かなりの進歩が見られました。しかし、慢性疾患の罹患率と死亡率の制御におけるこれらの薬剤の複合効果は控えめであり、これらの疾患は多発性疾患として同期して発生する傾向があり、有病率は70歳以降に指数関数的に増加します2。 健康寿命と寿命に影響を与えるいくつかの主要な要因は、さまざまな種にわたる研究を通じて特定され、9つの特徴に分類できる老化メカニズムとして定義されています。3。これらの基本的な老化メカニズムのうち、細胞老化は、複数の老化の併存疾患を予防または遅延させる創薬可能なプロセスを表すため、かなりの注目を集めています。4。1960年代に最初に報告された細胞老化とは、本質的に不可逆的な複製停止、深刻なクロマチン変化、アポトーシス抵抗性、タンパク質合成の増加を伴う細胞状態を指し、炎症性サイトカインの過剰産生に至ることがよくあります。これは、SASPと呼ばれる機能であると考えられています。老化の表現型とさまざまな加齢に伴う病状を促進する5。老化マーカーp16に陽性の老化細胞の除去INK4A 組織の変性を緩和し、動物の健康寿命を延ばし、老化細胞が生物の老化の原因となる役割を果たすという主張を支持します6、7。 前臨床試験の成功は、選択的な薬理学的除去を通じてin vivo老化細胞の負担を軽減する可能性のある、いくつかのヒト疾患の老化細胞除去薬を含む概念実証臨床試験の開始に影響を与えました。8、9、10。2015年の最初の発見以来(ref。 11)、少数の合成または低分子老化細胞除去剤が現在知られています。ターゲティング戦略は、主に老化細胞のアポトーシスに対する耐性メカニズムに基づいています。これは、老化細胞の長期間の生存を可能にする老化関連の抗アポトーシス経路に依存しているようです。12、13。老化細胞除去剤の断続的な投与は、患者が有害な状態を発症するリスクを減らし、薬剤のオフターゲット効果を最小限に抑え、分裂しない老化細胞の薬剤耐性の発生を防ぐ可能性を秘めています。癌細胞はしばしば、抗癌療法に対する耐性を提供する有利な突然変異を獲得します。ただし、ほとんどの報告された老化細胞除去剤は、細胞系統または細胞型に依存しているか、あるいは、インビボで実質的な細胞毒性を示し、したがって、臨床目的でのそれらの潜在的な使用を制限している。 この研究では、アンチエイジング剤で構成される天然物医薬品ライブラリーをスクリーニングし、GSEを含むいくつかの候補を特定しました。さらなる分析により、GSEフラボノイドのB型三量体エピカテキン成分であるPCC1が、低濃度でSASP発現を阻害し、高濃度で老化細胞を殺すのに主要な役割を果たしていることが明らかになりました。前臨床データは、古典的な化学療法と組み合わせて、PCC1が腫瘍サイズを大幅に縮小し、いくつかのマウスモデルで生存期間を延長できることを示唆しました。したがって、PCC1は、老化を遅らせ、加齢に伴う障害を改善し、臨床医学における潜在的なゲロプロテクターとしてのさらなる調査を保証する、天然資源から分離された新しいクラスの植物化学物質老化細胞を表します。 老化細胞を効果的に調節できる新しい化合物を特定するために、46種類の植物由来の薬剤で構成される植物化学物質ライブラリー(PDMAライブラリー)を使用して、偏りのない薬剤スクリーニングを実施しました。この目的のための細胞ベースのモデルとして、一次正常ヒト前立腺間質細胞株、PSC27を採用しました。主に線維芽細胞で構成されていますが、内皮細胞や平滑筋細胞を含む非線維芽細胞系統の割合はわずかですが、PSC27はそれ自体が初代細胞株であり、遺伝子毒性化学療法や電離放射線などのストレス要因にさらされた後、典型的なSASPを発現します14、15、16、17。これらの細胞を、事前に最適化された亜致死量のブレオマイシン(50μgml)で処理しました。-1)および観察された老化関連β-ガラクトシダーゼ(SA-β-Gal)染色の増加、5-ブロモデオキシウリジン取り込みの減少、および7〜10日後のDNA損傷修復(DDR)病巣の上昇(補足図。 1a – c)。個々の医薬品が老化細胞の生存と発現プロファイルに及ぼす影響を比較するためのスクリーニング戦略を設定しました(拡張データ図。 1a)。 老化細胞除去剤の有望な利点の1つは、ABT-263、ABT-737、およびダサチニブとケルセチンの併用などの老化細胞のプログラム細胞死を選択的に誘導することです。11、18、19。最初に、老化したPSC27細胞に対するこれらのゲロプロテクター薬の有効性をテストし、薬物スクリーニングの実験的細胞モデルとしての可能性を実証しました。私たちの予備データは、これらの化合物のそれぞれが老化細胞を有意に枯渇させたが、増殖細胞は枯渇させなかったことを示唆し、したがって、さらなる研究のためにこの間質細胞を使用する可能性を確認しました(拡張データ図。 1b)。PDMAライブラリーの大規模なスクリーニングの結果、培養中の老化細胞を選択的に殺す可能性のあるいくつかの化合物を特定しました(拡張データ図。 1c-e)。 予備的な老化防止効果を示した薬剤の中には、GSE、ケルセチン、フィセチン、クルクミン、ピペロンギュミンがありました(拡張データ図。 1d、e)。ケルセチンとフィセチンは同様の化学構造を共有し、同様の薬効を発揮し、両方とも老化細胞除去薬として知られています11、20、21。クルクミンとピペロンギュミンも、最近発見された老化細胞除去の可能性を持つ天然化合物です22、23。私たちはGSEに焦点を当てることを選択しましたが、これはまだほとんど調査されていない情報源でした。インビトロ条件下で、GSEは0.1875μgmlで最大効率でSASPを抑制しました-1 (拡張データ図。 2a)、これはセノモルフィックの特性に適合します24。低濃度または高濃度のGSEは、おそらく細胞毒性の増加の結果として細胞ストレス応答が誘導されたために、効果が低くなりました(拡張データ図。 2a)。RNA-seqを使用して、GSEで処理すると、老化細胞の発現プロファイルが大幅に変化し、遺伝子あたり2.0倍の変化で2,644個の遺伝子がダウンレギュレーションされ、1,472個の遺伝子がアップレギュレーションされることがわかりました(P <0.01)(拡張データ図。 2b)。SASPに関係のないいくつかの遺伝子の発現は、典型的なSASP因子と同様の傾向を示しましたが(拡張データ図。 2c)、私たちの遺伝子セット濃縮分析(GSEA)からのデータは、SASPの分子シグネチャーの発現低下または炎症誘発性表現型の重要なメディエーターである核因子(NF)-κB複合体の活性化をサポートしました(拡張データ図。 2d、e)。 NF-κB複合体の主要なサブユニットの1つであるp65の核移行は、老化細胞で観察され、SASP発現におけるその機能的関与と一致しています。14 (拡張データ図。 2f)。注目すべきことに、この傾向は、低濃度(0.1875μgmlなど)のGSEによって実質的に拮抗されました。-1)。逆に、NF-κBシグナル伝達の活性化は抑制されませんでしたが、GSEがより高い濃度(3.7500μgmlなど)で使用された場合、むしろ増強されたように見えました。-1)、これらの治療条件における老化細胞の異なる応答を示唆している。核画分におけるATMキナーゼのリン酸化によって証明されるDDRシグナル伝達の活性化、および細胞質画分で観察されるSASPの特徴的な因子の1つであるC–X–Cモチーフケモカインリガンド(CXCL)8の発現はNFと一致していました-これらの設定でのκBの活性化(拡張データ図。 2f)。 タンパク質間相互作用のプロファイリングにより、細胞老化時に有意にアップレギュレーションされたが、細胞がGSEに曝露されるとダウンレギュレーションされた複数の因子を含む非常にアクティブなネットワークが明らかになりました(拡張データ図。 3a)。遺伝子オントロジーのプロファイリングにより、これらの分子は生物学的プロセスに機能的に関与し、SASPの分泌された性質と一般的に一致する細胞成分に関連していることが明らかになりました(拡張データ図。 3b、c)。したがって、GSEは、特定の濃度範囲内で使用された場合に、老化細胞の炎症誘発性プロファイルであるSASPを制御する可能性を秘めた天然物です。GSEは、私たちの細胞ベースのアッセイで老化細胞除去効果を持つ唯一の天然物ではありませんでした(拡張データ図。 1d、e)、私たちのその後の研究は、そのゲロプロテクター能力が特に印象的であるように見えたので、主にGSEに焦点を合わせました。 老化作用物質としてのSASPの減少におけるGSEの有効性を考慮して、次に、老化細胞として作用することにより、より高濃度で老化細胞を殺すこの天然物の可能性を調査しました。SA-β-Gal染色は、老化細胞が0.75μgmlのGSE濃度で排除されたことを示した-1 (図。 1a、b)。3.75μgmlで-1 GSE、老化細胞の生存率が20%のプラトーに達しました(図。 1a、b)。 a、SA-β-Gal陽性による老化PSC27細胞生存の定量化。GSEは濃度を上げながら培地に適用されました。CTRL、制御(増殖)細胞; SEN、老化細胞; NS、重要ではありません。 P 値は、Tukeyの多重比較検定を使用した一元配置分散分析によって計算されました。 b、PSC27細胞を異なる濃度のGSEで処理した後のSA-β-Gal染色を示す代表的な画像。スケールバー、20μm。データは、3つの独立した実験を表しています。DMSO、ジメチルスルホキシド。 c、GSEで処理したときの対照および老化PSC27細胞の生存分析(0.3750、0.7500、1.8750、3.7500、7.5000および15.0000μgmlの濃度で)-1、 それぞれ)。データは平均±sdとして示され、3つの生物学的複製から得られました(n = 3つの独立したアッセイ)。 P 値は両側で計算されました t-テスト。 d、GSE(3.75μgml)による対照および老化PSC27細胞の処理時のinvitro生存率の経時的測定-1)。データは平均±sdとして示され、3つの生物学的複製から得られました(n = 3つの独立した実験)。 P 値は両側で計算されました t-テスト。 と、アネキシンV–FITCおよびヨウ化プロピジウム(PI)キットと4,6-ジアミジノ-2-フェニルインドール(DAPI)染色で処理してアポトーシスの程度を決定した後の、コントロールおよび老化PSC27細胞のフローサイトメトリー測定。Q1〜Q4、四分位数1〜4。 f、生存率の比較定量化(Q4、PI−アネキシンV−)およびアポトーシス(Q2およびQ3、PI+アネキシンV+ およびPI−アネキシンV+、それぞれ)ビヒクルまたはGSEで3日間処理された対照または老化集団の細胞(n = 3つの生物学的に独立したアッセイ)。 P 値は両側で計算されました t-テスト。 g、さまざまな条件下でのPSC27細胞におけるミトコンドリアスーパーオキシドインジケーターであるMitoSOXRedの蛍光シグナルの測定。 P 値は両側で計算されました t-テスト。 h、HPLC-ESI-QTOF-MSを実行した後のGSEのトータルイオンクロマトグラム(TIC)とベースピーククロマトグラムを示す高分解能質量スペクトル。特に明記しない限り、細胞は培養条件でのGSE処理の3日後に関連する分析にかけられました。cps、1秒あたりのカウント。棒グラフと回帰曲線のデータは平均±sdとして示され、3つの生物学的複製を表しています。NS、 P > 0.05; *P <0.05; ****P <0.01; ***P <0.001; ****P <0.0001。 細胞生存率アッセイは、GSEが老化細胞死を誘導したが、0.75μgmlの濃度から開始して増殖細胞死を誘導しなかったことを示した-1 (図。 1c)。7.50μgmlの濃度で-1、生存老化細胞の割合は約10%に低下しましたが、増殖細胞の生存率は15.00μgmlでも影響を受けませんでした-1 GSE(図。 1c)、私たちの細胞アッセイで使用される最高濃度であり、老化細胞の主要な特徴である老化細胞に対するGSEの顕著な選択性と特異性を示唆しています。 次に、GSEが老化細胞を経時的に特異的に標的化する能力を測定しました。3.75μgmlの濃度のGSEで処理した場合-1、老化細胞の生存率は、20時間後まで有意に減少しませんでした。老化細胞とコントロール(増殖細胞)の生存率の差は32時間後に最大に達し、老化細胞集団における老化細胞に対する内因性耐性の不均一性を示唆しています(図。 1d)。 GSEは老化細胞に対して明確な効果を生み出すため、細胞アポトーシスの誘導におけるGSEの有効性を分析しました。フローサイトメトリーは生存率の大幅な低下を示しましたが、老化細胞のアポトーシスは上昇しましたが、増殖細胞のアポトーシスは上昇しませんでした(図。 1e、f および補足図。 2a)。ミトコンドリアの機能障害と代謝の変化は、老化細胞と生物の老化、酸化ストレスを引き起こすイベント、スーパーオキシドなどの活性酸素種(ROS)の生成の特徴の1つです。3、25。ミトコンドリアのスーパーオキシドインジケーターであるMitoSOXRedを使用しました26、細胞間変化を精査し、GSEが老化細胞ではミトコンドリアROSの生成を促進したが、増殖細胞では促進しなかったことを発見した(図。 1g)。したがって、私たちのデータは、GSEがinvitroでアポトーシスの誘導とミトコンドリアストレスの悪化を介して老化細胞を殺すモデルと一致しています。 ブドウの種子は、乾物ベースでブドウの38〜52%に達し、抗酸化物質の豊富な供給源を構成します27。GSEの主要コンポーネントを特定するために、エレクトロスプレーイオン化(ESI)インターフェイスを備えた四重極飛行時間型質量分析(QTOF-MS)と組み合わせた高圧液体クロマトグラフィー(HPLC)を適用しました。フェノール酸、フラボノイド(フラバン-3-オール、プロシアニジンなど)、その他の化合物を含む、3つの主要な植物化学物質のカテゴリーが見つかりました(図。 1時間 および補足表 1)。それらの中で、いくつかの成分は、ミトコンドリアタンパク質を標的とし、複数の慢性疾患を軽減すると報告されているプロシアニジンおよびそれらの誘導体として同定されました。28。ただし、GSEの老化細胞除去機能を仲介する主要なコンポーネントは主に不明であります。 ブドウ種子プロシアニジンの報告されている生物学的活性には、酸化的損傷の軽減、炎症の抑制、および癌細胞のアポトーシスの誘導が含まれます29、30、31、32。GSEで見つかった個々の化合物の中で、PCC1は、DNA損傷を誘発し、細胞周期の停止を引き起こし、チェックポイントキナーゼの発現を増加させることが示されたため、特別な注意が必要です。33。HPLC-QTOF-MSによる植物化学物質自体の混合物であるGSEの予備分析(トータルイオンクロマトグラム)のデータは、特定のMSピークでのGSEのプロファイルが化学的に純粋なPCC1のクロマトグラムプロファイルと一致するため、PCC1の存在を示唆しました。商用ソースから取得(図。 1時間 および補足図。 2b)。 PCC1は、BCL-2のレベルを低下させますが、培養癌細胞におけるレギュレーターBAXの発現とカスパーゼ3および9の活性を増加させ、アポトーシスの誘導を通じて抗癌効果を生み出す可能性があることが示されました。33。したがって、次に、培養中の老化細胞を排除するためのPCC1の能力と選択性を評価しました。データは、PCC1が50μMの濃度で始まる老化間質細胞に対して老化細胞除去作用を示し、増殖細胞はほとんど影響を受けないままであることを示唆しています(図。 2a、b および補足表 2)。より高い濃度は老化細胞のより低い生存率を引き起こし、閾値は約200μMでしたが、PCC1は600μM以上で使用された場合にのみ対照細胞に対して毒性を示しました(図。 2b)。カスパーゼ3/7活性の時間経過は、PCC1が12時間以内にアポトーシス効果を発揮し、24時間でプラトーに達することを示しました(図。 2c)。この発見は、生存率の測定値とほぼ一致していました(図。 2d)。PCC1の老化細胞除去の性質は、複製の消耗または老化(RS)または癌遺伝子(HRAS)のために老化に入った細胞によって確認されましたG12V)過剰発現(OIS)。これは、治療によって誘発される老化と同様のストレスの多い発作を引き起こします(図。 2e、拡張データ図。 4b – e および補足表 2)。一緒に、結果は、PCC1が用量依存的に異なる刺激によって誘発された老化ヒト間質細胞を選択的に除去するが、適切な濃度で使用された場合、非老化細胞に有意な影響を与えないことを示唆している。 a、SA-β-Gal染色による老化PSC27細胞生存の測定。PCC1は増加する濃度で適用されました。 P 値は、Tukeyの多重比較検定を使用した一元配置分散分析によって計算されました。 b、PCC1濃度の増加でブレオマイシンによって誘導された老化PSC27細胞の生存。 c、カスパーゼ3/7活性のアポトーシスアッセイ。 d、PCC1処理後のPSC27細胞の生存率を評価するための経時的生存曲線。 と、SA-β-Gal染色の画像。TIS、治療によって誘発される老化(ブレオマイシンによる)。スケールバー、20μm。データは、3つの独立した実験を表しています。 f、アネキシンV–FITCおよびPIキットで処理した後のフローサイトメトリーおよびアポトーシスレベルを決定するためのDAPI染色。 g、実行可能率の定量化(Q4、PI−アネキシンV−)およびアポトーシス(Q2およびQ3、PI+アネキシンV+ およびPI−アネキシンV+、それぞれ)ビヒクルまたはPCC1で3日間処理した後の細胞(n = 3つの生物学的に独立したアッセイ)。 h、PSC27細胞の免疫蛍光染色。RSは、PCC1処理前の連続継代によって誘導されました。赤、p16INK4a。初期継代(P10)の細胞をネガティブコントロールとして使用しました。ABT-263(1.25μM)を陽性対照として試験しました。スケールバー、20μm。 私、免疫蛍光染色の統計。 j、パンカスパーゼ阻害(20μMQVD-OPh)後のPCC1誘導性老化細胞除去活性。 に、ヒトMSCのPDアッセイ。示されているように、PCC1は実験開始後8日目に適用された。BLEO、ブレオマイシン。にとって c、d、に、データは平均±sdとして示され、3つの生物学的複製から得られました(n = 3つの独立したアッセイ)。のデータについて b-d、g、私、j、 P 値は両側で計算されました t-テスト。の実験で c-に、PCC1は100μMで使用されました。特に明記しない限り、PCC1処理の3日後に分析のためにサンプルを収集しました。棒グラフのデータは平均±sdとして示され、3つの生物学的複製を表しています。NS、 P > 0.05; *P <0.05; ****P <0.01; ***P <0.001; ****P <0.0001。 細胞系統全体でPCC1の有効性を実験的に拡大および確立するために、ヒト胎児肺線維芽細胞(WI38)、初代ヒト臍帯静脈内皮細胞(HUVEC)、およびヒト間葉系幹細胞(MSC)をPCC1で処理し、これらすべての系統の老化細胞がPCC1による選択的切除についても同様の感受性がありますが、老化していない対応物は生存し続けました(拡張データ図。 4f–h および補足表 3)。さらに、フローサイトメトリーにより、PCC1に応答した老化細胞のアポトーシスの誘導を確認しましたが、増殖細胞はPCC1の影響をほとんど受けませんでした(図。 2f、g)。要約すると、私たちのデータは、PCC1がさまざまな細胞型にわたって老化細胞を選択的に排除し、老化のさまざまなトリガーから生じることを示しています。 PCC1による老化細胞の枯渇を視覚化するために、p16の発現を調べましたINK4a、RSを経験した間質細胞で広く使用されている老化のマーカー。PCC1は、継代後期のPSC27集団にのみ出現するp16陽性老化細胞を効果的に除去し、その有効性は、定評のある合成老化細胞であるABT-263(1.25μM)とほぼ同じです。18、21 (図。 2時間、私)。 PCC1を介した老化細胞の排除が、他の形態のプログラム細胞死ではなく、主にアポトーシスの誘導によって起こることを実証するために、我々は細胞をパンカスパーゼアポトーシス阻害剤キノリルバリルで処理しました。THE-メチルアスパルチル-(-2,6-ジフルオロフェノキシ)-メチルケトン(QVD-OPh)。老化細胞を殺すPCC1の能力はQVD-OPhによって逆転されました。したがって、PCC1は、老化細胞除去機能としてのカスパーゼ依存性アポトーシス誘導をABT-263と共有しています(図。 2j)。化学的阻害剤を用いたさらなる分析では、フェロトーシス、ピロトーシス、またはネクロトーシスによるPCC1誘発細胞死は除外されました(拡張データ図。 4i)。 遺伝子毒性薬による治療後の細胞集団倍加(PD)の可能性を評価するために、環境ストレスにさらされた後でも自己複製してコロニーベースの増殖を再開できるMSCを採用しました。34、おそらく損傷の不均一性が原因で、細胞が受ける損傷が少なく、おそらく自己回復して細胞周期に再び入る可能性を保持することができます24、35。治療後に急速に成長停止に入ったブレオマイシン損傷細胞とは異なり、PCC1による老化後の治療は、特にSASPを発達させ、細胞集団内でパラクリン老化を誘発する可能性を保持している老化細胞の除去後に、MSCのPD能力を有意に増強しました(図。 2k)。ただし、PCC1による処理は、増殖細胞のPDに影響を与えず、正常な細胞と比較した老化細胞に対するPCC1の選択性をさらに示しています。 GSEは複雑な植物化学物質の混合物であるため、その成分の多くが抗酸化作用と抗炎症作用を報告しています。27、36、PCC1が老化細胞の枯渇に関与するGSEの主成分であるかどうか、またはGSEの代替植物化学物質がその全体的な老化効果に寄与する可能性があるかどうかを調査しました。この目的のために、老化したPSC27細胞の生存に対する個々の植物化学物質の影響を調べました。ほとんどのGSE成分は、PCC1の用量範囲で老化細胞除去活性を示すことができず、増殖細胞の有意な死を引き起こしませんでした(補足図。 3 と 4)。フラボノイドケルセチンは以前の研究と同様に老化細胞除去活性を示しましたが、天然のフラボンと共有される特性11、21、「再構成されたGSE」、HPLC-QTOF-MSデータ(補足表)によって明らかにされた質量パーセンテージに従って混合された主成分で構成されています 1、ケルセチンはわずか0.9%を占めることに注意してください)が、意図的にPCC1を除外すると、両方のアッセイでPCC1で観察された結果と同様の結果は示されませんでした(補足図。 3 と 4)。他の成分が寄与しているかどうかを結論付けることはできませんが、私たちのデータは、PCC1がGSEの老化細胞除去効果の主要なメディエーターであることを明確に示唆しています。 老化細胞死を選択的に誘導するPCC1の顕著な有効性を考慮して、根本的なメカニズムを調査しました。PCC1はフラボノイドのスーパーファミリーに属しており、フリーラジカルを除去し、金属をキレート化し、ヒドロペルオキシドの形成、構造内の機能的な「-OH」基に起因する抗酸化特性、およびフラボノイド分子の環上の位置を低減できます。27。プロシアニジンの抗酸化能力は、部分的にはそれらの重合度によって支配されますが、PCC1は本質的にプロシアニジンエピカテキン三量体です(図。 3a)。 a、三量体エピカテキンPCC1の化学構造。 b、老化したPSC27細胞では有意にアップレギュレーションされたがPCC1処理(50μM)ではダウンレギュレーションされた上位遺伝子(50)を示すヒートマップ。赤い星、SASP因子。 c、SASPスペクトルの重要な遺伝子セットのGSEAプロット。FDR、誤検出率; NES、正規化された濃縮スコア。 d、NF-κBを介したシグナル伝達に関連する重要な遺伝子セットのGSEAプロット。 と、典型的なSASP関連因子のタンパク質間相互作用のNetworkAnalystマップは、老化細胞では有意にアップレギュレーションされますが、PCC1処理によってダウンレギュレーションされます。 f、コントロール、老化およびPCC1処理老化細胞におけるBCL-2ファミリー遺伝子の差次的発現を示すヒートマップ。 g、さまざまな薬剤に曝露されたPSC27細胞のイムノブロット。アポトーシス促進性および抗アポトーシス性因子ならびにDDRシグナル伝達関連分子の発現を調べた。カスパーゼ3(t)、総カスパーゼ3; カスパーゼ3(c)、切断されたカスパーゼ3; p、リン酸化。β-アクチンおよびGAPDH、ローディングコントロール。データは、3つの独立した実験を表しています。 h、細胞は、ターゲティングする3つの異なるショートヘアピンRNA種に感染しました 怪我 また プーマ 老化を誘発するためにブレオマイシンにさらされる前。7日後、細胞をPCC1(100μM)で3日間処理してアポトーシスを誘導しました。SCR、スクランブル。 私、 怪我 発現は、逆転写を伴う定量PCR(RT–qPCR)を使用して決定されました。10μMMK2206、10μMルキソリチニブまたは20 nM BMS-582949の非存在下または存在下で100μMPCC1に3日間曝露する前に、細胞をブレオマイシンで処理して老化を誘導し、AKT、JAK1および/またはJAK2またはp38の活性を阻害しましたそれぞれMAPK。 j、RT-qPCR発現アッセイの同様のセット プーマ で説明されている条件を使用する 私。 に-m、MK2206の非存在下または存在下でのPCC1処理後の細胞生存率の測定(に)、ルキソリチニブ(L)またはBMS-582949(m)、AKT、JAK1および/またはJAK2またはp38MAPKの酵素活性をそれぞれ阻害するために含まれています。のデータについて c、d、 P 値は、Tukeyの事後比較を使用した一元配置分散分析によって計算されました。の統計的有意性 h-m 両面を使用して計算されました t-テストまたは一元配置分散分析(ダネットの検定)。すべての棒グラフのデータは平均±sdとして示され、3つの生物学的複製を表しています。NS、 P > 0.05; *P <0.05; ****P <0.01; ***P <0.001; ****P <0.0001。 まず、老化細胞のトランスクリプトーム全体の発現に対するPCC1の影響を分析しました。バイオインフォマティクスは、PCC1処理後の間質細胞で4,406個の遺伝子が有意にアップレギュレーションされ、2,766個の遺伝子がダウンレギュレーションされたことを示しました(補足図。 5a)。多数のSASP因子が観察され、その発現は細胞老化中に著しくアップレギュレーションされましたが、老化細胞がPCC1に曝露されると実質的にダウンレギュレーションされました(図。 3b)。GSEAプロファイリングは、SASPとNF-κBの両方のシグネチャがPCC1処理によって著しく抑制されたことを示しました(図。 3c、d)。さらに、老化中にアップレギュレーションされ、PCC1処理後にダウンレギュレーションされるこれらの因子間の複数の相互作用または機能的接続が、発現差のある上位遺伝子のリストに表示され、そのほとんどが通常分泌因子であることに気づきました(図。 3e)。 老化細胞に対するPCC1の選択性を理解するために、トランスクリプトミクス発現プロファイルをさらに評価し、PCC1がいくつかのBCL-2スーパーファミリーメンバーで発現変化を誘導することに気づきました(図。 3f)。DDRシグナル伝達はほとんど影響を受けませんでしたが、PCC1依存性のアップレギュレーションまたはp38マイトジェン活性化プロテインキナーゼ(MAPK)の活性化が観察され、これらの細胞でカスパーゼ3の切断が起こりました(図。 3g)。BCL-xLの発現は、増殖中のコントロールと比較して老化細胞で上昇しましたが、PCC1処理はそのタンパク質レベルをさらに高めることはありませんでした。他の2つのBCL-2因子、すなわちBCL-2とBAXのレベルは、ほとんど変化していませんでした。NOXAとPUMA(BCL-2相同性ドメイン3(BH3)のみのアポトーシス促進性サブファミリーの2つのメンバー)は細胞老化中に異なる発現パターンを示しましたが、PCC1治療は両方の因子のアップレギュレーションをもたらしました(図。 3g)。 BCL-2アポトーシス促進因子のノックダウンは、NOXAとPUMAがPCC1の老化作用を部分的に媒介することを示唆しました(図。 3時間 および拡張データ図。 5a–c)。AKTキナーゼ、ヤヌスキナーゼ(JAK)1、JAK2、およびp38 MAPKシグナル伝達の化学的阻害剤による治療も、これらのシグナル伝達経路が PMAIP1 ((怪我) と BBC3 ((プーマ)およびPCC1処理後の老化細胞アポトーシス(図。 3i–m)。 ノックダウンとして 怪我 と プーマ PCC1の老化細胞除去効果を部分的にしか阻害しませんでした(図。 3時間、k – m)、老化細胞死につながる他の可能なメカニズムを調査しました。プロシアニジンは通常、細胞の生存率を高めるため、哺乳類細胞のROS産生を減少させ、酸化ストレスを抑制します37、38、次に、PCC1に曝露された老化細胞で同様の効果または抗酸化効果が観察されるかどうかを尋ねました。驚いたことに、老化したPSC27細胞は、増殖している細胞とは対照的に、PCC1で処理するとROSレベルの上昇を示したため、逆のことがわかりました(図。 4a および拡張データ図。 5d、2'-7'-ジクロロジヒドロフルオレセインジアセテート(DCFH-DA)プローブからのシグナルに注意してください)。フリーラジカル消去活性を持つ安定したレスベラトロール類似体であるHS-1793による治療39、PCC1で処理された老化細胞におけるROS産生を効果的にブロックしました(拡張データ図。 5e、f)、一方、ROSレベルは、PCC1で処理された老化細胞をプロトノフォアミトコンドリア脱共役剤であるCCCPに曝露した後にさらに増加しました。40、またはミトコンドリア外膜の透過化を誘導する両親媒性カチオン性ペプチドであるルキソテミチド(LTX-315)41、それぞれが対照細胞に対して細胞毒性を示さない濃度で適用された(拡張データ図。 5e、f)。CCCPまたはルキソテミチド自体のいずれかによる治療もROS産生の増強を引き起こしましたが、その効果は一般にPCC1によって誘発される効果よりも小さく、PCC1が老化細胞のミトコンドリア機能障害を引き起こすことを示唆しています。老化細胞のアポトーシス指数(カスパーゼ3/7活性)を測定することにより、PCC1と各ミトコンドリア破壊因子の組み合わせでPCC1誘導効果がさらに増強されるが、HS-1793との同時処理では抑制されることがわかりました(拡張データ図。 5g)。 a、細胞の酸化還元状態の変化に敏感な細胞透過性蛍光プローブであるDCFH-DAを使用したROSレベルの測定。PCC1処理の1日後に実験を行った。左、代表的な画像。スケールバー、10μm。そう、統計。DCF、ジクロロジヒドロフルオレセイン。 b、細胞をさまざまな処理に曝露した後のイムノブロット。ミトコンドリアと細胞質の間のシトクロムcの分布は、PCC1処理の3日後にサイトゾルの上清からミトコンドリアを分離することによってプロファイルされました。COX IVは、ミトコンドリア呼吸鎖の末端酵素であり、ミトコンドリアマーカーです。 c、天然プロシアニジンファミリーの別のメンバーであるPCB2で処理したときのPSC27細胞の生存率を評価するための経時的生存曲線。データは平均±sdとして示され、3つの生物学的複製から得られました(n = 3つの独立したアッセイ)。 d、に記載されているのと同様の方法で実施されるROS産生アッセイ a、細胞がPCB2にさらされたことを除いて。スケールバー、10μm。 と、細胞質と核の間のATM、p53およびカスパーゼ3の発現と分布のイムノブロット。GAPDHとラミンA / C、それぞれ細胞質と核のローディングコントロール。C1、PCC1; B2、PCB2。 f、ビヒクル(DMSO)またはPCC1で細胞を処理した後の免疫蛍光染色の共焦点顕微鏡。p53またはCOXIVに特異的な一次抗体を適用しました。スケールバー、10μm。 g、さまざまな薬剤に曝露されたPSC27細胞のイムノブロット分析。細胞質、細胞質; 水戸、ミトコンドリア。 h、JC-1染色の分析、Δψmを示す蛍光プローブ。信号は3日間にわたって測定されました。緑色の蛍光は、JC-1モノマーを示します(ミトコンドリア膜の脱分極後にサイトゾルに現れ、初期のアポトーシスを示します)。赤色蛍光は、JC-1の凝集を示します(無傷のミトコンドリアに存在します)。左、代表的な画像。そう、統計。PCC1とPCB2の両方が、関連するアッセイで100μMで使用されました。のデータ b、と-g 3つの独立した実験の代表です。の統計的有意性 a (正しい)、 d (右)と h (右)は両面を使用して計算されました t-テスト、そしてそれ c 一元配置分散分析(ダネット検定)を使用して計算されました。すべての棒グラフのデータは平均±sdとして示され、3つの生物学的複製を表しています。NS、 P > 0.05; *P <0.05; ****P <0.01。 シトクロムcの放出とミトコンドリア膜の破壊は、アポトーシスに関連する細胞内イベントであり、多くの場合、直接的なアポトーシスドライバーとして機能します42。私たちのデータは、PCC1処理がミトコンドリアから周囲の細胞質空間へのシトクロムcの放出を増強したことを示唆しています(図。 4b および拡張データ図。 5時間)。ミトコンドリアからのシトクロムcの放出は、PCC1で処理された老化細胞におけるカスパーゼ活性化などの生化学的反応とほぼ一致しています(図。 3g)。 プロシアニジンファミリーのメンバーは、老化細胞をPCC1で処理したときに観察されたものとは逆の、抗酸化および抗炎症を含む幅広い薬理学的特性を示します。現在のデータは、PCC1の効果が他のプロシアニジンによって再現されるかどうかを推論するように促しました。プロシアニジンB2(PCB2)は、二量体として存在し、培養細胞の酸化ストレス中にROSレベルを低下させる代表的なフラボノイドです。43。PCB2は老化細胞を排除できませんでした(図。 4c および補足図。 3b と 4b)そして老化細胞におけるシトクロムcの増強されたROS産生も誘導されたミトコンドリア放出もありません(図。 4d および拡張データ図。 5i)。NF-κB複合体の主要サブユニットの1つであるかなりの量のp65(RelA)が、老化細胞の核に移行しました(図。 4e)。PCB2治療は、その抗炎症能力と一致するp65核転座を打ち消しましたが、この効果はPCC1によって再現されませんでした(図。 4e)。PCC1に曝露された老化細胞は顕著なカスパーゼ3切断を示しましたが、PCB2で処理された細胞はそうではなく、これら2つのプロシアニジン分子の生物学的活性をさらに区別しました(図。 4e)。 細胞の運命を機能的に支配する因子として、p53はアポトーシス促進遺伝子をトランス活性化することによって、またはミトコンドリアに移動することによって転写に依存しない方法でアポトーシスを誘導することができます44。細胞老化の際にp53の核転座の増加が観察されました。これは、PCC1によって著しく減少したパターンですが、PCB2によるパターンよりもはるかに少ないパターンです(図。 4e、f)。p53の核排除は老化細胞アポトーシスの誘導における重要なステップであるため45、p53の分布をさらに評価しました。免疫蛍光染色は、PCC1処理老化細胞におけるp53とチトクロームcオキシダーゼサブユニットIV(COX IV)(ミトコンドリア呼吸電子伝達系の膜貫通タンパク質複合体、しばしばミトコンドリア常在タンパク質マーカーとして使用される)との重複の実質的な増加を示し、ミトコンドリアマトリックスへのp53。増殖細胞のミトコンドリアでいくつかのp53を観察しましたが、PCC1は増殖細胞のミトコンドリアマトリックスへのp53タンパク質の顕著なまたは包括的な流入を誘導しませんでした(図。 4f)。しかし、老化細胞では、p53レベルは核では減少しましたが、PCC1への曝露時にミトコンドリアでは増加しました(図。 4g)。 ミトコンドリア膜電位(Δψm)の低下は、ミトコンドリアを介した内因性経路を介してアポトーシスを引き起こす可能性のあるイベントです46。JC-1プローブシグナルのプロファイルが示すように、老化細胞ではΔψmが大幅に減少し、増殖細胞はPCC1の存在下では基本的に影響を受けないことがわかりました(図1)。 4時間)。したがって、PCC1はROSの生成を促進し、シトクロムcの放出を引き起こし、老化細胞にΔψm障害を引き起こします。これは、ミトコンドリアの障害に本質的に関連し、細胞のアポトーシスを機能的に促進するイベントです。 一緒に、私たちの実験データは、老化細胞が部分的に媒介されるプロセスであるPCC1誘導アポトーシスの影響を受けることを示唆しています 怪我 と プーマ ダウンレギュレーションと強化されたROS生産とミトコンドリア機能障害に関連付けられています。 インビトロで老化細胞を排除するためのPCC1の能力と選択性を考慮して、次に、この薬剤を利用して、インビボで加齢に伴う病状に介入できるかどうかを調べた。臨床腫瘍学では、薬剤耐性はほとんどの抗がん治療の有効性を制限しますが、老化細胞は、薬剤損傷腫瘍微小環境(TME)でのin vivoSASPの開発を通じて治療抵抗性に寄与することがよくあります。15、16、47。治療によって誘発された老化細胞の薬理学的排除は、化学療法の副作用を最小限に抑え、動物の癌再発を防ぎます48。ただし、抗癌治療の有効性を高めるために原発腫瘍から老化細胞のPCC1を介した枯渇の実現可能性はほとんど知られていません。 まず、PSC27細胞を高悪性度の典型的な前立腺癌細胞株であるPC3細胞と事前に最適化された比率(1:4)で混合することにより、組織組換え体を構築することを選択しました。14。次に、細胞を非肥満糖尿病と重症複合免疫不全症(NOD-SCID)のマウスの後腹部に皮下移植しました。動物の腫瘍は8週間の期間の終わりに測定され、組織は病理学的評価のために取得されました。PC3癌細胞とナイーブPSC27間質細胞を含む腫瘍と比較して、PC3細胞と老化PSC27細胞で構成される異種移植片は有意に増加した体積を示し、老化細胞の腫瘍増殖促進効果を確認しました(拡張データ図。 6a)。 臨床状態を模倣するために、遺伝子毒性治療薬および/または老化細胞除去薬を組み込んだ前臨床レジメンを実験的に設計しました(図。 5a)。皮下移植の2週間後、in vivoでの腫瘍の安定した取り込みが観察されたとき、ミトキサントロン(MIT、化学療法薬)またはプラセボの単回投与が3、5、7週目の1日目に動物に送達されました。 8週間のレジメン(拡張データ図。 6b)。プラセボ治療群とは対照的に、MITの投与は腫瘍の成長を著しく遅らせ、化学療法剤としてのMITの有効性を検証しました(腫瘍サイズの44.0%の減少)(図。 5b)。特に、PCC1自体の投与は腫瘍の縮小を引き起こしませんでしたが、MITによる治療とそれに続くPCC1送達(最初のMIT投与の2週間後に腹腔内(ip)注射を介して20 mg / kgで投与し、その後隔週で送達)は腫瘍退縮を著しく増強しました(55.2 MIT単独と比較した腫瘍サイズの%減少;プラセボ治療と比較した腫瘍体積の74.9%減少)(図。 5b)。 a、前臨床レジメンの説明図。皮下移植と組織組換え体のinvivo取り込みの2週間後、NOD-SCID雄マウスは、数サイクルからなるメトロノームスケジュールで単剤(単剤)または複合剤(二重)のいずれかを投与されました。BLI、生物発光イメージング。 b、腫瘍エンドボリュームの統計的プロファイリング。PC3細胞は、単独で、またはPSC27細胞と一緒に動物の後部脇腹に異種移植された。 c、SA-β-Gal染色によるinvivo老化の比較評価。動物を殺した後、腫瘍を新たに解剖し、組織学的染色のために凍結切片として処理した。スケールバー、200μm。 d、腫瘍組織におけるSA-β-Gal染色の比較統計を示すバイオリン図。 と、腫瘍から単離された間質細胞におけるいくつかの標準的なSASP因子のインビボ発現のための転写物アッセイ。間質細胞と癌細胞の両方を異種移植した動物の組織を、レーザーキャプチャーマイクロダイセクションでサポートされた分離とその後のプロセスにかけました。データは3つの生物学的複製の代表です(n =グループあたり10匹の動物)。データセットは箱ひげ図として表示されます。箱ひげ図では、ボックスが25パーセンタイルから75パーセンタイルまで伸び、中央値が中央の線で示され、ひげが最小値と最大値を示します。 f、間質細胞におけるSASP転写物のプロファイリング。各因子に対応するシグナルは、ビヒクル処置群からのシグナルに正規化された。ノート p16INK4a としても知られています CDKN2A と p21CIP1 としても知られています CDKN1A。 g、に記載されているように収集された生体試料中のDNA損傷を伴う細胞およびアポトーシス細胞の統計的測定 a、b。値は、ヒストンγH2AXまたはカスパーゼ3(切断)に特異的な抗体で免疫組織化学(IHC)によって陽性に染色された細胞のパーセンテージとして表されます。にとって b、d-g、 P 値は両側で計算されました t-テスト。 h、治療レジーム終了時のカスパーゼ3(切断、CC3)の代表的なIHC画像。スケールバー、100μm。 私、進行したかさばる病気の発症後に殺されたマウスの生存率の比較。生存期間は、組換え組織注射の時から動物の死まで計算された。MS、生存期間中央値。 P 値は、両側ログランク(Mantel–Cox)検定によって計算されました。のデータ c、h 3つの独立した実験の代表です。すべての棒グラフのデータは平均±sdとして示され、3つの生物学的複製を表しています。 次に、これらの動物の腫瘍病巣で細胞老化が起こったかどうかをテストしました。当然のことながら、MITの投与は腫瘍組織に多数の老化細胞の出現を誘発しました。しかし、これらの化学療法で治療された動物へのPCC1の送達は、老化細胞の大部分を枯渇させました(図。 5c、d)。レーザーキャプチャーマイクロダイセクションとそれに続く転写アッセイは、以下を含むSASP因子の発現の有意な増加を示しました IL6、 CXCL8、 SPINK1、 WNT16B (としても知られている WNT16)、 GM-CSF (としても知られている CSF2)、 MMP3 と IL1A、老化マーカーp16をコードする遺伝子のアップレギュレーションを伴う傾向INK4a 化学療法で治療された動物(図。 5e および拡張データ図。 6c)。これらの変化は、隣接する癌細胞ではなく、主に間質細胞で観察されました。これは、治療によって損傷を受けたTMEで後天的な耐性を頻繁に発現する残存癌細胞の再増殖の可能性を示唆しています。しかし、PCC1を投与すると、転写産物アッセイとRNA-seqによって示唆されるように、SASP関連の変化は大幅に逆転しました(図。 5f および拡張データ図。 6d)。 MIT治療マウスにおけるSASP発現の根底にあるメカニズムを調査するために、耐性コロニーが発生する前の時点であるGSE送達の初回投与の7日後にこれら2つの薬剤で治療した動物から腫瘍を解剖しました。プラセボ治療とは対照的に、MIT投与はDNA損傷とアポトーシスを増加させましたが、PCC1単独での治療は増加しませんでした(図。 5g)。ただし、MITで治療した動物にPCC1を同時投与すると、DNA損傷とアポトーシスが大幅に増加し、化学療法と老化細胞除去薬の両方を投与された動物の細胞毒性が増強されたことを意味します。裏付けとなる証拠として、PCC1をMITと一緒に投与した場合、細胞アポトーシスの典型的な特徴であるカスパーゼ3切断の上昇が観察されました(図。 5時間)。 次に、さまざまな動物グループの生存率を経時的に比較することにより、腫瘍の進行の結果を評価しました。この前臨床コホートでは、動物の腫瘍増殖をモニターし、腫瘍量が顕著になると(サイズが2,000 mm以上)、かさばる病気が発生したと見なしました。3)、以前の研究で採用されたアプローチ14、49。MIT-PCC1の組み合わせ治療を受けたマウスは、生存期間の中央値が最も長く、MITのみで治療されたグループよりも少なくとも48.1%長く生存しました(図。 5i、緑対青)。ただし、PCC1治療だけでは、生存期間はわずかに延長されました。私たちのデータは、PCC1の単独投与は腫瘍の成長を変化させず、動物の生存を促進しないことを示唆していますが、PCC1とMITの同時投与は有意な相乗効果をもたらします。 注目すべきことに、これらの研究で行われた治療は、尿素、クレアチニンまたは肝臓の酵素レベルまたは体重に有意な摂動が観察されなかったため、動物によって十分に許容されるように見えました(拡張データ図。 6e、f)。さらに重要なことに、この研究で最適化された用量で投与された化学療法剤およびゲロプロテクター剤は、免疫適格マウスにおいてさえ、免疫系の完全性または重要な臓器の組織恒常性を有意に妨害しなかった(補足図。 6a–c)。これらの結果は、従来の化学療法と組み合わせたアンチエイジング剤が、重度の全身毒性を引き起こすことなく腫瘍反応を増強する可能性があるという理論的根拠を裏付けています。 少数の老化細胞でさえ、若い動物に身体機能障害を引き起こす可能性があります50。PCC1がinvivoで老化細胞を選択的に殺し、それによって身体機能障害を防ぐことができるかどうかを尋ねました。この質問に対処するために、コントロールと老化マウスの胚性線維芽細胞(MEF、0.5×10)の並行移植を行いました。6 片側あたりの細胞)構成的にルシフェラーゼを発現する(LUC+)同系野生型(WT)マウスの皮下注射。移植直後に、動物をPCC1(腹腔内注射により1kgあたり20mg)またはビヒクル(10:30:60のエタノール-ポリエチレングリコール400-Phosal 50プロピレングリコール(PG))で7日間処理しました(図。 6a)。LUCを移植したマウスの治療後に差は観察されなかったが、老化細胞を移植し、PCC1で治療したマウスの発光シグナル強度は、ビヒクルで治療した同腹仔のそれよりも有意に低いことがわかった。+ コントロールセル(図。 6b、c)、invivoでのPCC1の老化細胞除去効果を実証します。 a、5ヶ月齢のC57BL / 6J雄マウスにおける細胞移植および身体機能試験の実験手順の概略図。 b、マウスの最後の治療の2日後のinvivoルシフェラーゼ活性を示す代表的な画像。スケールバー、20mm。 c、ビヒクル処置動物における平均シグナルに対するパーセンテージとしての移植細胞の発光。 d-f、最大歩行速度の測定(ベースラインと比較して)(d)、吊り下げ耐久性(と)と握力(f)5ヶ月齢のC57BL / 6J雄マウスで、最後の治療から1ヶ月後に試験を実施。 g、移植および身体機能測定のための実験計画の概略図。 h-j、最大歩行速度の測定(ベースラインと比較して)(h)、吊り下げ耐久性(私)と握力(j)28週齢のC57BL / 6J雄マウス(最後の治療から2週間後)。 に、0.5×10を移植した17ヶ月齢の動物の1年生存曲線6 MEF細胞を制御し、ビヒクル(CTRL-ビークル)および0.5×10を移植したマウスで処理6 ビヒクル(SEN-ビヒクル)またはPCC1(SEN-PCC1)のいずれかで処理された老化MEF細胞。赤い矢じり、細胞移植(528日齢)または生存測定の終了(890日齢)。 P 値は、両側ログランク(Mantel–Cox)検定によって計算されました。 L、老化細胞の移植およびビヒクルまたはPCC1による治療後の疾患負荷(左)および腫瘍負荷(右)(四分位範囲の中央値として示されている)の比較定量化。 m、移植された細胞を受け取り、ビヒクルまたはPCC1で治療された動物の死因。にとって d-f、h-j、データは箱ひげ図として表示されます。箱ひげ図は25パーセンタイルから75パーセンタイルまで伸びており、中央値は中央に線で示され、ひげは最小値と最大値を示します。にとって c-f、h-j、 P 値は両側で計算されました t-テスト。動物の数、 n =グループあたり5 c、 n =グループあたり10 d-j、 n = 27 for に と n = 13 for L、m。NS、 P > 0.05; *P <0.05; ****P <0.01; ***P <0.001; ****P <0.0001。 次に、PCC1を使用して移植された老化細胞を殺すことが、病理学的事象、特に身体機能障害を軽減できるかどうかを調査しました。老化細胞移植後1週間PCC1で若い動物を治療すると、最大歩行速度(RotaRod)、吊り下げ耐久性(吊り下げテスト)、握力(握力)の低下が防止されました。老化細胞は、PCC1が身体機能障害を軽減する可能性と一致しています(図。 6d–f)。PCC1の投与はまた、老化細胞の移植から5週間後に動物に発生した身体機能障害を予防しました(図。 6g)。老化細胞を宿すマウスでは、PCC1治療の単一の5日間のコースは、ビヒクル治療と比較して身体機能を改善しました(図。 午前6時-d)。注目すべきことに、改善はPCC1治療の2週間後に検出可能であり、数か月間も持続しました(拡張データ図。 7a、b)。PCC1投与のこれらの2つの時点(老化細胞移植の直後と5週間後)では、PCC1の有益な効果は同等であるように見えました。データは、PCC1投与のタイムラインが柔軟であり、その潜在的な臨床的実現可能性を示している可能性があることを示唆しています。植物種子由来のプロシアニジンは通常、排出半減期が12時間未満であるため51、52、PCC1治療の単一コース後の身体機能のそのような持続的な改善は、老化細胞誘発性の身体機能障害を回避するのに十分であることをさらに意味する、老化細胞による継続的な治療の必要性を回避します。 次に、老化細胞の影響または中年の動物におけるそれらの除去の利点を評価しようとしました。この目的のために、コントロールまたは老化したMEFを移植した17か月齢のC57BL / 6Jマウスを使用しました。特に、老化細胞を保有し、翌年にビヒクル治療を受けた動物の生存率は、PCC1治療を受けた動物の生存率よりも有意に低く、死亡のリスクは2.4倍高かった(ハザード比、 P = 0.0172)(図。 6k)。しかし、ビヒクルで治療したマウスとPCC1で治療したマウスの間で、疾病負荷、死亡時の腫瘍負荷、および死因に有意差はありませんでした(図。 6リットル、m)。これらのデータは、少数の老化細胞が、特定の病状やいくつかの個別の状態を引き起こすのではなく、老化の進行を加速するなどの一般的なプロセスを通じて生存に影響を与える可能性があることを示唆しています。老化細胞の負担を増大させると、身体機能障害が生じます。これは、中年期の死亡率に関連する傾向ですが、PCC1などの老化細胞除去薬の投与によって延期される可能性があります。 老化細胞除去薬は、さまざまな病態生理学的状況で多様な組織や臓器の老化細胞を枯渇させますが、そのほとんどは加齢と相関しています53。生物の老化細胞と生物の老化に対するPCC1の影響をさらに調べるために、治療に挑戦したマウスと自然に老化したマウスを含む、invivo老化の2つの独立した動物モデルを選択しました。まず、WTマウスを致死量以下の線量(5 Gy)で全身照射(WBI)に曝し、その後PCC1(ip注射で20 mg / kg)またはビヒクル(エタノール-ポリエチレン)でゲロプロテクター治療を行うことにより、細胞老化を誘発しました。グリコール400–Phosal 50 PG、10:30:60)(週に1回)(図。 7a)。注目すべきことに、WBIを受けた動物は、著しく灰色の髪を含む異常な体の外観を示しましたが、PCC1の投与によって大幅に逆転しました(図。 7b、c)。SA-β-Gal陽性の老化細胞は、心臓および肺組織の染色陽性の増加によって証明されるように、これらの動物でインビボで誘導された(図。 7d、e)。しかし、腹腔内注射によってPCC1で処理した場合、WBI後の段階でビヒクルで処理したマウスとは異なり、解剖した組織のSA-β-Gal陽性細胞の割合が大幅に減少しました(図。 7f、g)。PCC1治療はまた、ビヒクル治療と比較して、老化マーカーおよび主要なSASP因子のサブセットの発現を減少させました(図。 7時間)。要約すると、データは、PCC1がSA-β-Gal陽性細胞を効果的に枯渇させ、SASP発現を制御し、マウスのinvivo条件下で老化細胞の負担を最小限に抑えることができることを示唆しています。 a、WBIおよび身体機能検査を経験しているマウスの実験手順の概略図。 b、ナイーブで、WBIに曝露された後にビヒクル治療を受けた、またはWBIに曝露され、PCC1で治療されたC57BL / 6J雄マウスの全身スナップショット比較。 c、で説明されている動物のケージ内の写真 a 前臨床条件下で。 d、ビヒクルまたはPCC1処理を受けた未処理(ナイーブ)およびWBI処理マウスの心臓組織のSA-β-Gal染色の代表的な画像。スケールバー、200μm。 と、に記載されているマウスの肺組織のSA-β-Gal染色の代表的な画像 d。スケールバー、200μm。 f、で調べた動物の心臓組織のSA-β-Gal染色の比較統計 d。 g、で調べた動物の肺組織のSA-β-Gal染色の比較統計 と。 h、に記載されている条件下で処理された動物から収集された組織における転写レベルでのSASP発現の定量的測定 a。 私、j、トレッドミルでの走行距離の測定(私)と握力(j)実験マウスの。にとって f-j、 P 値は両側で計算されました t-テスト。 に、WBIに曝露され、ビヒクルまたはPCC1で毎週治療されたC57BL / 6Jマウスのカプラン・マイヤー生存分析。未治療の対照としてナイーブマウスが使用されました。CI、信頼区間; HR、ハザード比; DFI、無病期間。 P 値は、両側ログランク(Mantel–Cox)検定によって計算されました。棒グラフのデータは平均±sdとして示され、3つの独立した実験を表しています。NS、 P > 0.05; *P <0.05; ****P <0.01; ***P <0.001; ****P <0.0001。 次に、前臨床治療がマウスの身体的パラメーターに与える影響を評価しました。予想通り、WBIは、車両グループのトレッドミルおよび握力アッセイで測定した場合、運動能力と筋力を大幅に低下させました(図。 7i、j)。対照的に、PCC1の管理は、これらの能力を回復するという実質的な利益をもたらしました。さらに重要なことに、PCC1治療は生存率を高めました(図。 7k)。我々の結果は、PCC1が誘導するSA-β-Gal陽性老化細胞の排除が、細胞毒性療法などの環境ストレス要因によって引き起こされる早期老化の状況において、老化関連の身体的退行を軽減し、死亡率を低下させる効果的な戦略である可能性があることを示しています。 次に、自然に老化した動物の身体機能に対する老化細胞の影響を定義しようとしました。この目的のために、通常の20か月齢のWTマウスをビヒクル(エタノール-ポリエチレングリコール400-Phosal 50 PG、10:30:60)またはPCC1(20 mg / kg、腹腔内注射)(2週間に1回)で治療しました。 4ヶ月間(図。 8a)。組織学的評価により、老化した動物の腎臓、肝臓、肺、および前立腺におけるSA-β-Gal陽性老化細胞の割合が有意に上昇していることが明らかになりましたが、これはPCC1処理によって逆転しました(図。 8b、c および拡張データ図。 8a–f)。物理的試験の結果は、PCC1を投与した動物の最大歩行速度、吊り下げ耐久性、握力、トレッドミル耐久性、日常活動、およびビームバランス性能を、ビヒクルで治療した動物と比較して強化することにより、PCC1が身体機能障害を軽減したことを示しました(図。 8d–i)、PCC1投与マウスでは、体重と摂餌量はほとんど変化していませんでした(拡張データ図。 8g、h)。特に、SASPの発現は、PCC1で治療した老齢マウスの肺などの組織で、ビヒクル治療群と比較して有意に減少しました(図。 8j)、PCC1で処理されたヒト間質組織によるSASP因子の分泌が少ないことと一致するパターン(図。 5f)。 a、PCC1で2週間に1回(隔週)4ヶ月間治療された20ヶ月齢のC57BL / 6J雄マウスの身体検査の概略設計。 b、ビヒクルまたはPCC1で処理された若齢および老齢マウスからの腎臓のSA-β-Gal染色の代表的な画像。スケールバー、200μm。 c、に記載されているSA-β-Gal染色の定量化 b。データは平均±sdを表します d-h、最大歩行速度の定量化(ベースラインと比較して)(d)、吊り下げ耐久性(と)、 握力 (f)、トレッドミルの持久力(g)と日常の活動(h)4ヶ月の治療後の20ヶ月齢のC57BL / 6J雄マウスの。 私、平均台を横切るのに必要な時間の定量化。各動物の治療前後のデータポイントを接続して、治療効果を直接比較できるようにします。 j、生後6か月の未治療(6M)、24か月齢のビヒクル治療(24M-ビヒクル)および24か月齢のPCC1治療マウス(24M-PCC1)から収集した肺組織におけるSASP発現の定量的転写プロファイリング。データは平均±sdとして示され、3つの生物学的複製から得られました(n = 3つの独立したアッセイ)。 に、生後24〜27か月のマウス(雌雄)の寿命分析のための概略設計。 L、m、治療後の生存(L)および終身生存(m)PCC1で隔週で処理されたC57BL / 6J動物の曲線(n = 91; 男性48名、女性43名)または車両(n = 80; 生後24〜27か月で、男性42名、女性38名)。 n、人生の最後の2か月間で平均した最大歩行速度と吊り下げ耐久性(n =グループあたり10匹のマウス)および両方のグループで最も長生きするマウス(上位20匹)の寿命。 The、死亡時の疾病負荷と腫瘍負荷。男女ともに、 n =腕あたり60匹のマウス。男性の場合、 n = PCC1の場合は31および n =車両の場合は33。女性の場合、 n = PCC1の場合は29および n =車両の場合は27。にとって c-h、j、 n = 3つの生物学的に独立したアッセイ。データは箱ひげ図として表示されます。箱ひげ図では、ボックスが25パーセンタイルから75パーセンタイルまで伸び、中央値が中央に線で示され、ひげは最小値と最大値を示します(d-h、n)または平均±sd(The)。対になっていない両側 t-テスト(c-j、n、The)およびCox比例ハザード回帰モデル(L、m)統計的有意性を決定するために使用されました。 老化細胞の除去がWTマウスの残りの寿命を延ばす可能性を確立するために、私たちは非常に古い年齢からPCC1治療を行いました(図。 8k)。生後24〜27か月(ヒトでは75〜90歳とほぼ同等)からPCC1投与(2週間に1回または隔週)を受けたマウスは、治療後の寿命の中央値が64.2%長くなりました(または全体で9.4%長くなりました)。寿命)およびより低い死亡率の危険性(65.0%、 P <0.0001)ビヒクル治療群より(図。 8リットル、m)。これらのデータは、PCC1が老齢マウスの加齢に伴う死亡のリスクを大幅に低下させる可能性があることを示しています。 次に、老齢動物の死亡率の低下が晩年の罹患率の増加を犠牲にしてもたらされたかどうかを質問しました。PCC1またはビヒクルで死亡するまで毎月治療した実験マウスの身体機能を測定しました。PCC1で治療したマウスの余命は長くなりましたが、最後の2か月の身体機能は、ビヒクルで治療したマウスよりも有意に低くはありませんでした(図。 8n)。剖検時に、いくつかの加齢に伴う病状、腫瘍量、および死因の発生率は、PCC1治療マウスとビヒクル治療マウスの間で有意差はありませんでした(図。 8o および拡張データ図。 9a、b)。ただし、SASPの発現は固形臓器で減少し、これはインターロイキン(IL)-6、コロニー刺激因子(CSF)2、および単球走化性タンパク質(MCP)1の代表的なSASPマーカーの循環レベルの低下とほぼ互換性がありました。末梢血中(拡張データ図。 9c – f)。CD3でのSASPの発現低下も観察されました+ 末梢血中のT細胞(拡張データ図。 9g)、p16の強力な増加を示す細胞系統INK4a 人間の老化中の発現54。さらに、PCC1処理は、脂質過酸化生成物である4-ヒドロキシノネナール(HNE)の付加物の減少と、還元型グルタチオンと酸化型グルタチオンの比率の増加によって証明されるように、肝臓組織の酸化ストレスを低減しました(拡張データ図。 9時間、私)、フリーラジカルを中和し、抗酸化防御システムに関与することによって抗酸化活性を発揮するフラボノイドの一般的な特性と一致しています55、56。 要するに、老化細胞およびおそらく他の細胞の負担を軽減することができるのは、GSEに由来する(または、より少ない量で、シナモン、カカオ、リンゴの皮、松樹皮などの天然産物に由来する)植物化学成分である老化細胞除去剤PCC1です。炎症誘発性の表現型を発達させ、生存促進性の老化に関連する抗アポトーシス経路に本質的に依存し、マウスの罹患率を上昇させることなく治療後の寿命を延ばします。ここに、晩年に投与された場合でも、そのような治療法が加齢性機能障害を著しく遅らせ、加齢性疾患を軽減し、健康状態を改善し、それにより改善するための新しい道を提供するという顕著な可能性を秘めているという原理の証拠を提示します。将来の老年医学における健康と寿命。 老化は本質的に避けられないプロセスであり、ほぼすべての生物の機能低下を徐々に引き起こします。恒久的な成長停止の状態である細胞老化は、最近、老化の特徴と推進力の両方として浮上しています。3、57。老化細胞は時間の経過とともに老化した組織に蓄積し、病状のリストの増加に貢献します58。早老症または自然老化したマウスからの老化細胞の除去は、健康寿命を延ばし、寿命を延ばし、アテローム性動脈硬化症、変形性関節症、および神経変性疾患を含むがこれらに限定されない加齢性障害を抑制する59、60、61、62。加齢に伴う研究の最近の進歩により、老化細胞を選択的に標的とすることができる薬剤、特に老化細胞除去薬またはそれほど積極的ではないが老化細胞除去薬と呼ばれる新しいクラスのゲロプロテクターの探索が促されました。現在までに、ダサチニブとケルセチン、フィセチン、ピペロンギミン、熱ショックタンパク質(HSP)90阻害剤、ABT-263(ナビトクラックス)やABT-737などのBCL-2ファミリー阻害剤を含む少数の老化細胞除去薬が報告されています(参考文献。 11、12、13、18、19、21、22)。その中で、BCL-2阻害剤は、もともとリンパ腫の治療法として開発されたものの、最も広く使用されている老化細胞除去薬です。ABT-737は、BCL-2、BCL-xL、およびBCL-wを対象としていますが、溶解度が低く、経口バイオアベイラビリティがあります。インビボでの使用により効果的であるABT-263は、主にBCL-2およびBCL-xLを阻害しますが、血小板減少症を引き起こすことがよくあります。一部の老化化合物の顕著な副作用を考えると、老化活性はあるが細胞毒性が低下している新しい化合物を特定する必要があります。この研究では、最適なin vivoの有効性と安全性で老化細胞を広く標的とすることができる新しい薬剤を特定することを目的として、主に天然物で構成されるPDMAベースの薬物ライブラリーをスクリーニングしました。その結果、広域スペクトルの老化細胞として、天然由来の植物化学物質であるPCC1を同定しました。特別な利点として、PCC1は、低濃度で使用した場合にSASP発現を最小限に抑えるためのセノモルフィック剤としても機能します。PCC1のこのような有利な機能は、実際、GSEの機能にほぼ類似しており、老化細胞除去効果と老化細胞除去効果の両方を生み出すことができます。 遺伝的および薬理学的戦略は、老化を遅らせ、病気を制御するために老化細胞を排除することの一連の利点を示しました。細胞老化は、発癌性の活性化、遺伝子毒性ストレスから、炎症反応や倦怠感に至るまで、さまざまな刺激によって引き起こされる可能性があります。いくつかの化合物は広域スペクトル老化細胞として識別されますが、他の化合物は特定のタイプの老化細胞に対してのみ選択的です。特異性の違いは、老化細胞除去薬の個々の選択を意味し、主にそれらの意図された臨床使用に依存します。最近の研究では、強心配糖体ファミリーに属する天然化合物であるウアバインが、老化細胞の除去と癌治療の両方に使用できる老化細胞除去剤として明らかになりました。63。この研究では、PCC1を別の新しい、自然で強力な老化細胞として発見しました。これは、老化細胞のアポトーシスを選択的かつ特異的に誘導しますが、増殖細胞に対する細胞毒性は限られています。64。注目すべきことに、低濃度では、PCC1はSASP発現を阻害します。これは、アピゲニンやケンペロールなどの植物由来のフラボノイドが共有する特性であり、老化細胞が加齢に伴う状態に与える影響を制限するためのセノモルフィックとして機能します。65、66。老化細胞を標的とする天然物質のそのような二重のメカニズムを明らかにした研究はほとんどありませんが、最近合成されたケルセチン表面はFeを官能化しました3THE4 ナノ粒子は、AMP活性化プロテインキナーゼ(AMPK)活性を増強することにより、ヒト線維芽細胞において老化細胞除去とセノモルフィックの両方の可能性を示しました67。 PCC1が老化細胞除去効果を達成するメカニズムは複雑に見え、さらなる研究が必要です。私たちのデータは、PCC1がミトコンドリアの機能的完全性を損ない、Δψmを損ない、ROSなどのフリーラジカルの生成を増加させ、老化細胞ではシトクロムcの放出を引き起こしますが、増殖細胞では引き起こさないことを示唆しています。この特異性の考えられる理由は、老化細胞が脱分極した原形質膜を発達させる傾向があり、Hの濃度が増加していることです。+ (参照。 64)、PCC1のアクションの影響を受けやすくする可能性のある機能。注目すべきことに、これらの変化は、アポトーシス促進因子、特にNOXAおよびPUMAの発現のアップレギュレーションを伴います。これらのイベントは、老化細胞のアポトーシスも決定的に促進します。プロシアニジンのファミリー内で、そのメンバーはフラバン-3-オール分子の重合に由来し、オリゴマーまたはポリマーとして存在することが知られています28、PCC1は機能的にユニークなようです。私たちの実験データは、PCC1(三量体)と他のプロシアニジン(そのほとんどは実際にPCB2などの単量体または二量体)の間に顕著な違いがあることを示唆しています。プロシアニジンファミリーのメンバーを包括的に分析しなかったため、分子内のモノマーの数がその老化防止の可能性を決定するかどうかは未解決ですが興味深い質問であり、根本的なメカニズムは今後も継続して研究する価値があります。 細胞老化それ自体は、異なる細胞起源と環境刺激に依存する非常に不均一なプロセスです68。PCC1の重要な機能の1つは、複製、癌遺伝子、照射、化学療法など、さまざまな種類の細胞やストレッサーの老化細胞を効率的に除去できることです。この研究では、PCC1を他の報告されている老化細胞除去薬と比較して、組織の微小環境における主要な細胞型であるヒト間質細胞、線維芽細胞、HUVECおよびMSCへの影響を調べました。報告されているように、ABT-263は老化したヒト胚性線維芽細胞(HEF)とHUVECを排除しますが、ヒト前脂肪細胞にはほとんど影響を与えません。12、18。ダサチニブとケルセチンを併用すると、3種類の老化細胞すべてが用量依存的に枯渇する可能性がありますが、増殖中の細胞には毒性があります。11、69、70。老化細胞除去剤として報告されている別の天然フラボノイドであるフィセチンは、高濃度でのみ老化HEFおよび前脂肪細胞に中程度の効果を示します20、21。対照的に、PCC1は、細胞型依存性、非老化細胞での高い毒性、老化細胞に対する低い効率など、これらの制限を克服する可能性があります。ケルセチン(GSEの別のフラボノイド)自体を単独で使用すると、老化した間質細胞に対して細胞毒性を示しましたが、その有効性は一般にPCC1よりも低くなっています(図を比較してください)。 2a、c および補足図。 3n と 4n)。同時に、PCC1は、ABT-263、ダサチニブ、ケルセチン、フィセチンなどの多くの報告されている老化細胞よりも幅広い細胞タイプに対して高い特異性と効率を備えた優れた老化活性を持ち、いくつかの主要なタイプの老化誘導物質によって生成される老化細胞を標的にすることができます。 PCC1がinvivo条件下で老化細胞にアポトーシス誘導効果を発揮することを発見しました。PCC1は、治療によって誘発された老化細胞を効果的に排除し、固形臓器の老化マーカーを減少させ、invivoでのその有効性を強調しました。この研究では、自然に老化したマウスをPCC1で処理し、老化細胞、慢性炎症、および身体機能に対するその効果をテストしました。まず、GSEA分析で示されるように、PCC1処理により、複数の組織の老化細胞が枯渇し、SASP関連のシグネチャが減少しました。第二に、PCC1は、老化した肝臓と腎臓でのSASP関連遺伝子の発現を抑制し、血液中の慢性的な軽度の炎症を軽減する可能性があります。第三に、PCC1は、老齢マウスの運動機能障害、バランス、運動不足、筋力、自発的探索を軽減しました。最も重要なこと、PCC1処理グループのRotaRodおよびビームバランステストのパフォーマンスは、初期の前処理条件のパフォーマンスと比較して改善されました。まとめると、植物化学物質の化合物PCC1は、組織の微小環境内の老化細胞を選択的に標的とし、自然に老化したマウスに顕著な生物学的効果をもたらします。 化学的に合成された対応物と同様に、天然由来のプロシアニジンは、抗炎症、抗関節炎、抗アレルギー、および抗癌活性を示し、酸素フリーラジカルを除去し、放射線誘発過酸化活性を抑制します36、71。PCC1は、植物材料から、最も顕著にブドウの種子から分離されたエピカテキン三量体として、慢性的な病的状態において健康上の利点を提供することが示されました。72。ただし、in vivoでのPCC1の毒物学的影響の徹底的な評価は、潜在的な臨床応用にとって非常に重要です。私たちのデータは、高濃度(20 mg / kg)および高周波PCC1(隔週)治療には明らかな全身毒性がないことを示しました。要約すると、私たちの研究は、広範囲の細胞型にわたって老化または治療損傷組織の老化細胞を選択的に標的とするゲロプロテクター戦略の優位性と相対的な安全性を示しています。ただし、in vivoでのPCC1濃度は臓器によって異なり、投与量、薬力学、薬物動態に依存する可能性があり、一部の組織タイプでは局所濃度が老化細胞除去効果を達成するのに十分な高さではない可能性があります。この場合、 全体として、私たちの研究は、健康寿命を延ばし、寿命を延ばし、老化に関連する病状を、天然資源に由来し、顕著な有効性を有する老化治療薬(老化細胞除去薬と老化細胞除去薬の両方)で治療するための新しい道を開きます。前臨床アッセイで実証されたPCC1の潜在的なアンチエイジング効果は、PCC1のさらなる翻訳および臨床開発を強力にサポートし、より長く健康的な生活を実現することを目的としています。主要
結果
低濃度のGSEはSASP発現を抑制します
GSEは高濃度で老化細胞除去活性を持っています
GSEのPCC1コンポーネントには老化細胞除去活性があります
PCC1は老化細胞のミトコンドリア機能障害を誘発します
PCC1は腫瘍の退縮を促進し、化学療法抵抗性を低下させます

PCC1治療の結果としての老化細胞の除去は身体機能障害を軽減します
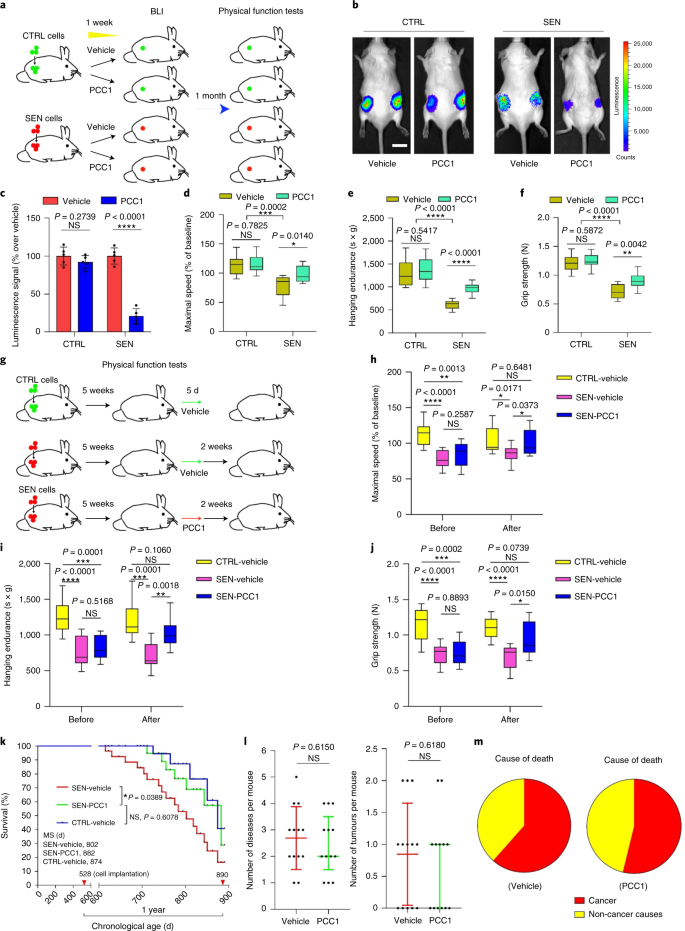
PCC1は身体機能を維持し、老齢マウスの生存を延長します
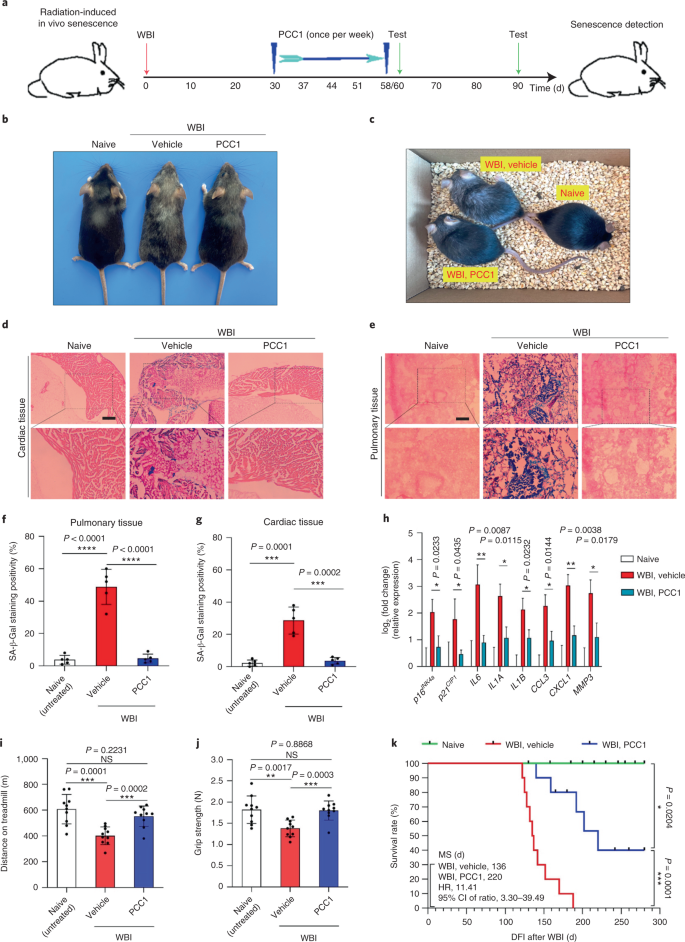
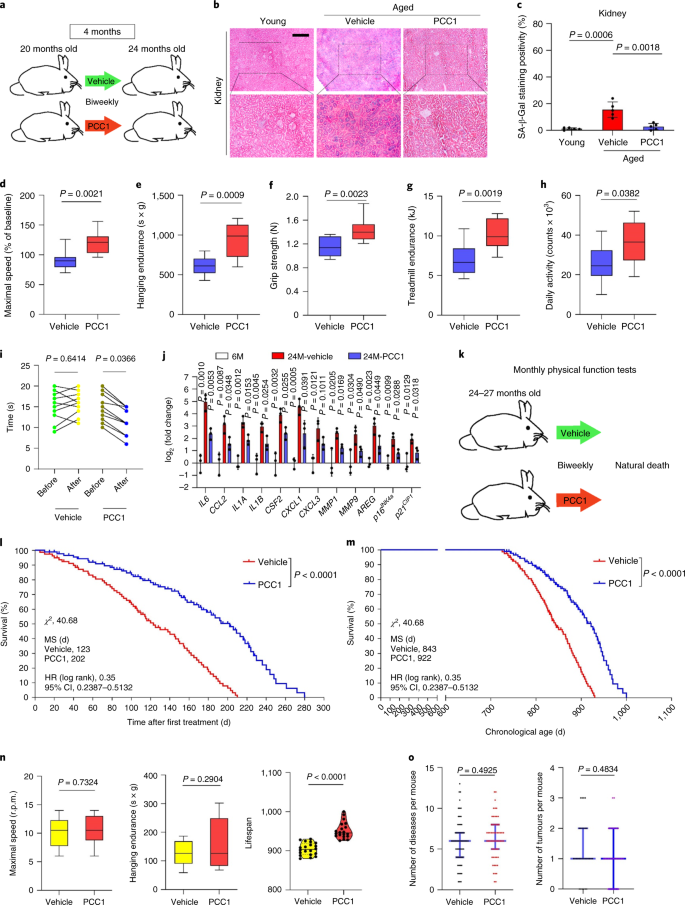
討論




